Nhiệt phân KClO3 là phản ứng quen thuộc trong ngành hóa chất, đặc biệt được nhiều doanh nghiệp ứng dụng để điều chế oxi tinh khiết phục vụ nghiên cứu và sản xuất. Với ưu điểm dễ tiến hành trong phòng thí nghiệm và hiệu quả cao, phản ứng này giúp tiết kiệm chi phí, đảm bảo an toàn và nâng cao năng suất.
Nhiệt phân KClO3 là gì?
Nhiệt phân là thuật ngữ chỉ phản ứng hóa học trong đó một chất bị nung nóng và phân hủy thành những chất đơn giản hơn. Đối với KClO3 nhiệt phân, khi đun nóng ở nhiệt độ cao và trong điều kiện thích hợp, cấu trúc phân tử của hợp chất này bị phá vỡ, tạo ra những sản phẩm mới.

Kali clorat trong điều kiện thường
Vậy KClO3 nhiệt phân ra gì? Thông thường, sản phẩm chính là KCl và O2, đặc biệt khi có mặt xúc tác MnO2 giúp quá trình diễn ra nhanh và hiệu quả hơn. Tuy nhiên, trong một số điều kiện nhất định, chẳng hạn nhiệt độ chưa đủ cao hoặc không có xúc tác, KClO3 còn có thể tạo ra muối oxy hóa cao hơn như KClO4.
Phương trình nhiệt phân KClO3
Kali clorat (KClO3) khi được đun nóng đến nhiệt độ thích hợp sẽ xảy ra phản ứng nhiệt phân KClO3, tạo thành kali clorua (KCl) và khí oxi (O2). Đây là phản ứng phân hủy điển hình trong hóa học vô cơ, thường được khai thác để điều chế oxi trong phòng thí nghiệm. Phương trình phản ứng cơ bản được biểu diễn như sau:
2KClO3 (r) => 2KCl (r) + 3O2 (k)
Trong phản ứng này, KClO3 đóng vai trò là chất bị phân hủy, còn oxi được giải phóng ra ở trạng thái khí. Đặc biệt, nhiệt phân KClO3 có xúc tác MnO2 giúp phản ứng diễn ra ở nhiệt độ thấp hơn, an toàn và hiệu quả hơn, đồng thời tránh sự hình thành sản phẩm phụ như KClO4.
KClO3 đóng vai trò là chất bị phân hủy trong phản ứng nhiệt phân
Điểm đặc biệt là phản ứng phân hủy KClO3 không chỉ đơn thuần tạo ra sản phẩm mới, mà còn minh họa rõ cơ chế phân hủy muối oxi hóa mạnh. KClO3 vốn có tính oxi hóa rất mạnh, khi nhiệt phân, nó giải phóng một lượng oxi lớn, thuận lợi cho các ứng dụng trong công nghiệp và nghiên cứu.
Điều kiện nhiệt phân KClO3
Để phản ứng nhiệt phân Kali clorat đạt hiệu quả, cần chú ý đến nhiệt độ, xúc tác và cách tiến hành. Khi nung kali clorat ở khoảng 400 độ C, muối này bắt đầu phân hủy. Tuy nhiên, nếu chỉ tiến hành nhiệt phân KClO3 không xúc tác, sản phẩm có thể gồm cả KCl, O2 và tạo thêm KClO4, làm giảm hiệu suất phản ứng. Phương trình minh họa:
4KClO3 => 3KClO4 + KCl
Trong khi đó, với nhiệt phân KClO3 xúc tác MnO2, phản ứng diễn ra ở nhiệt độ thấp hơn, an toàn và nhanh hơn, đồng thời hạn chế tối đa sự hình thành KClO4. MnO2 đóng vai trò chất xúc tác, giúp quá trình ổn định, hiệu suất cao và tiết kiệm năng lượng.
Ngoài yếu tố xúc tác, tốc độ gia nhiệt cũng ảnh hưởng đáng kể. Nung quá nhanh có thể khiến khí O2 thoát ra đột ngột, gây bắn tung muối hoặc phản ứng không đều. Ngược lại, khi gia nhiệt từ từ và duy trì ở mức thích hợp, phản ứng diễn ra ổn định, sản phẩm thu được nhiều hơn, đảm bảo an toàn trong thực nghiệm cũng như ứng dụng công nghiệp.
Sản phẩm của quá trình nhiệt phân KClO3
Khi KClO3 bị nhiệt phân hủy, sản phẩm thu được sẽ phụ thuộc vào điều kiện phản ứng như nhiệt độ, có hay không chất xúc tác và dạng muối. Đây là yếu tố then chốt quyết định hiệu suất thu khí oxi cũng như độ tinh khiết của chất rắn sau phản ứng.
Trong điều kiện có xúc tác MnO2 hoặc ở nhiệt độ cao trên 500 độ C, KClO3 phân hủy trực tiếp thành kali clorua và khí oxi. Đây là phản ứng được sử dụng phổ biến trong các thí nghiệm điều chế oxi tại trường học, vì KClO3 dễ kiếm, còn KCl là muối bền và ít gây nguy hại.

KClO3 phân hủy trực tiếp thành kali clorua
Tuy nhiên, nếu nhiệt độ chỉ ở mức khoảng 400 độ C và không có xúc tác, KClO3 không phân hủy hoàn toàn thành KCl và O2 mà tạo ra thêm KClO4 cùng với KCl. Đây là sản phẩm phụ hoặc trung gian, phản ánh cơ chế oxi hóa – khử phức tạp của ion ClO3(-).
Đối với muối ngậm nước như KClO3.5H2O, quá trình nhiệt phân còn trải qua một giai đoạn khử nước trước khi phân hủy muối khan. Ở giai đoạn này, sản phẩm đầu tiên thoát ra là hơi nước, sau đó phản ứng tiếp tục như với KClO3 khan để tạo ra KCl, O2 và đôi khi cả KClO4 nếu điều kiện chưa tối ưu.
Vai trò của phản ứng nhiệt phân KClO3 trong thực tế
Phản ứng nhiệt phân Kali clorat không chỉ mang tính lý thuyết mà còn có nhiều ứng dụng quan trọng trong thực tiễn. Khi được nung nóng với xúc tác MnO2, KClO3 phân hủy tạo ra KCl và khí O2 tinh khiết. Đây là cơ sở để phản ứng này được dùng phổ biến trong thí nghiệm nhiệt phân KClO3 nhằm điều chế oxy phục vụ giảng dạy và nghiên cứu hóa học.
Phản ứng nhiệt phân Kali clorat tạo ra khí oxy
Trong công nghiệp, khí oxy sinh ra từ phản ứng này đóng vai trò duy trì sự cháy trong các hỗn hợp dễ cháy, nên KClO3 thường được ứng dụng trong sản xuất diêm, pháo hoa và thuốc nổ. Oxy giải phóng tại chỗ giúp quá trình cháy diễn ra mạnh mẽ và ổn định.
Tuy nhiên, phản ứng cũng tiềm ẩn rủi ro nếu không kiểm soát đúng điều kiện, bởi có thể tạo ra KClO4 – một chất oxy hóa rất mạnh, dễ gây cháy nổ. Vì vậy, việc áp dụng phản ứng này trong thực tế luôn cần tuân thủ quy trình kỹ thuật và biện pháp an toàn nghiêm ngặt.
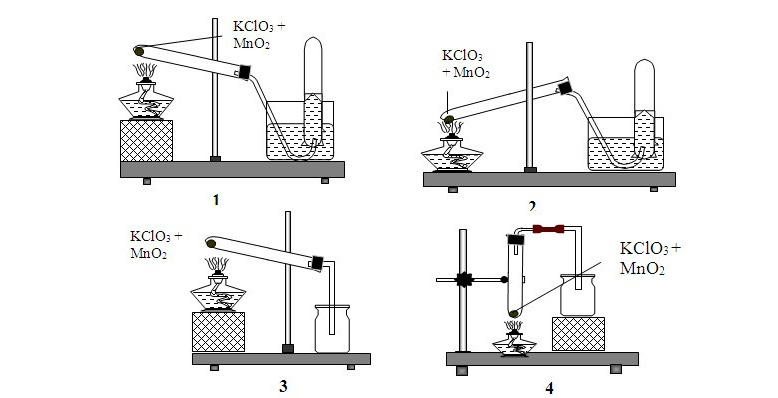
Cách tiến hành thí nghiệm nhiệt phân KClO3 trong phòng thí nghiệm
Để tiến hành thí nghiệm, cần chuẩn bị KClO3 rắn tinh khiết, một lượng nhỏ MnO2 làm xúc tác, ống nghiệm chịu nhiệt, kẹp giữ, ống dẫn khí, bình thu khí úp nước và nguồn nhiệt. Trong phòng thí nghiệm người ta nhiệt phân KClO3 bằng cách trộn KClO3 với MnO2, sau đó cho hỗn hợp vào ống nghiệm và nối với hệ thống dẫn khí.
Khi nung nóng từ từ đến khoảng 400 – 500 độ C, KClO3 phân hủy thành KCl và giải phóng O2, khí này được dẫn vào bình úp nước để thu. Khi khí thoát ra hết, dừng nung và tháo hệ thống để tránh nước tràn ngược vào ống nghiệm.
Chất rắn còn lại chủ yếu là KCl, có thể dùng để phân tích tính hiệu suất phản ứng. Trong quá trình làm thí nghiệm, cần chú ý không nghiền KClO3 quá mịn, không trộn lẫn với chất dễ cháy và luôn đặt ống nghiệm hơi nghiêng để tránh vỡ do hơi nước ngưng tụ.
Có thể thấy, nhiệt phân KClO3 không chỉ là phản ứng quan trọng trong nghiên cứu hóa học mà còn mang lại nhiều ứng dụng thực tiễn cho doanh nghiệp. Việc nắm rõ cơ chế, phương trình thực hiện giúp tận dụng hiệu quả nguồn oxi sinh ra, đồng thời kiểm soát rủi ro an toàn. Với sự kết hợp giữa kiến thức chuyên môn và quy trình đúng chuẩn, doanh nghiệp có thể tối ưu hiệu suất sản xuất, tiết kiệm chi phí và tạo lợi thế cạnh tranh bền vững.


