Trong thế giới vật chất đa dạng, mỗi phân tử đều được hình thành nhờ sự tương tác đặc biệt giữa các nguyên tử. Chính nhờ cơ chế liên kết hóa học mà các chất có thể tồn tại, phát triển và thể hiện những tính chất độc đáo của mình, từ đó tạo ra sự phong phú trong tự nhiên cũng như trong đời sống con người.
Liên kết hóa học là gì?
Sự kết nối giữa các nguyên tử là yếu tố nền tảng tạo nên sự phong phú và đa dạng của thế giới vật chất.
Trong hóa học, sự kết nối giữa các nguyên tử là yếu tố nền tảng tạo nên sự phong phú và đa dạng của thế giới vật chất. Khi các nguyên tử, ion hoặc phân tử hút nhau và hình thành nên những cấu trúc ổn định như phân tử hay tinh thể, đó chính là hiện thân của khái niệm liên kết hóa học. Cơ chế tương tác này giúp giải thích không chỉ cấu trúc và tính chất của các chất, mà còn làm sáng tỏ nhiều hiện tượng trong tự nhiên. Việc nắm bắt rõ cách các hạt liên kết với nhau còn mang lại những ứng dụng thiết thực trong sản xuất vật liệu, chế tạo dược phẩm hay phát triển công nghệ mới.
Cơ sở hình thành liên kết hóa học giữa các nguyên tử
Việc các nguyên tử kết nối với nhau để tạo thành chất không xảy ra ngẫu nhiên, mà dựa trên nguyên lý ổn định năng lượng. Trong tự nhiên, các nguyên tử có xu hướng điều chỉnh lại cấu hình electron để đạt trạng thái bền vững giống khí hiếm gần nhất – thường là đạt 8 electron ở lớp ngoài cùng (quy tắc octet) hoặc 2 electron đối với các nguyên tử nhỏ như hydro và heli (quy tắc duet). Để đạt được điều đó, chúng có thể nhường, nhận hoặc cùng chia sẻ electron, tạo nên sự ràng buộc về mặt năng lượng.
Nói cách khác, liên kết hóa học là sự kết hợp giữa các hạt nhằm đạt đến cấu trúc bền vững nhất. Theo lý thuyết liên kết hóa học, chính cơ chế tương tác electron này đã tạo nên bản chất và đặc điểm riêng của mỗi chất, từ đó ảnh hưởng đến tính chất vật lý và hóa học mà chúng thể hiện.
Phân loại các loại liên kết hóa học
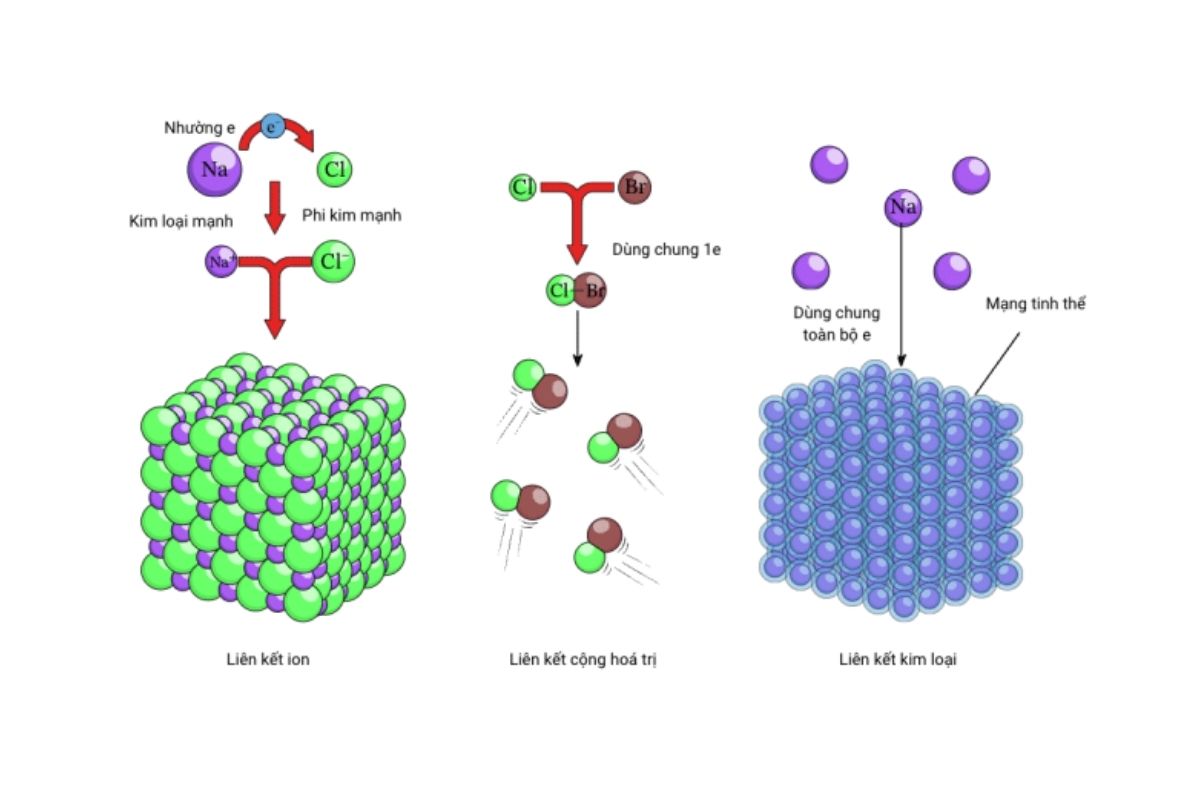
Có 3 loại liên kết phổ biến: ion, cộng hóa trị, kim loại và hydro.
Trong thế giới vi mô, cách các nguyên tử kết nối với nhau tạo nên sự đa dạng và đặc tính riêng biệt của vật chất. Vậy có mấy loại liên kết hóa học chính? Theo lý thuyết hiện đại, có bốn loại phổ biến nhất: ion, cộng hóa trị, kim loại và hydro.
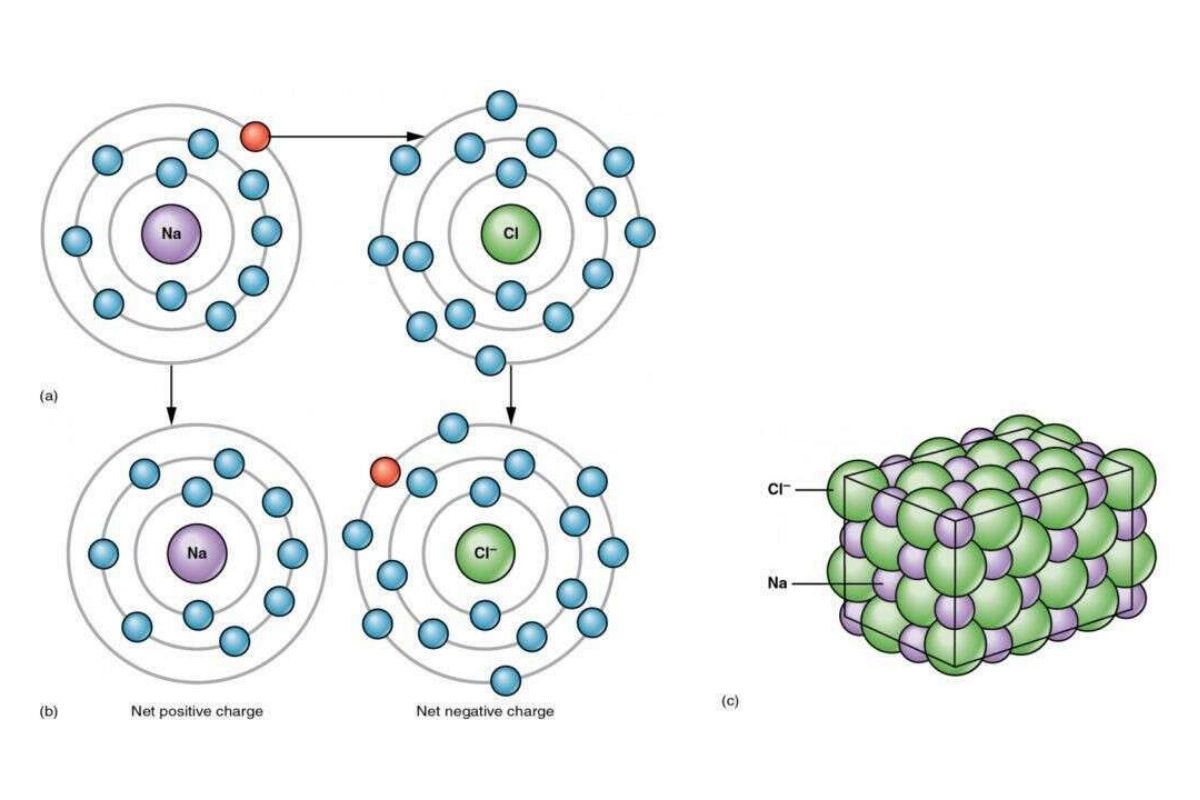
Liên kết ion hình thành khi nguyên tử kim loại nhường electron cho phi kim, tạo nên các ion trái dấu hút nhau mạnh mẽ – điển hình như NaCl. Với liên kết cộng hóa trị, các nguyên tử (thường là phi kim) cùng chia sẻ electron để đạt trạng thái bền vững; loại này có thể phân cực hoặc không phân cực tùy vào hiệu độ âm điện giữa các nguyên tử.
Liên kết kim loại là sự chia sẻ electron tự do trong mạng lưới ion dương, giúp kim loại dẫn điện, dẫn nhiệt và dễ uốn. Còn liên kết hydro – tuy yếu hơn – lại đóng vai trò quan trọng trong cấu trúc nước và các phân tử sinh học như ADN.
Ngoài bốn dạng chính trên, còn có liên kết phối trí và lực Van der Waals. Việc nắm vững các loại liên kết trong hóa học không chỉ giúp hiểu bản chất chất liệu mà còn phục vụ cho các ứng dụng quan trọng trong công nghệ và đời sống.
Tại sao nguyên tử lại liên kết với nhau?
Các nguyên tử không tồn tại cô lập mà có xu hướng kết hợp với nhau.
Trong tự nhiên, các nguyên tử không tồn tại cô lập mà có xu hướng kết hợp với nhau để tạo nên những cấu trúc ổn định hơn. Việc liên kết này giúp hệ thống đạt trạng thái năng lượng thấp hơn và cấu hình electron bền vững hơn – thường theo quy tắc octet hoặc duet, nơi lớp vỏ ngoài cùng được lấp đầy. Khi liên kết được hình thành, năng lượng của hệ giảm xuống (enthanpi âm), làm cho phân tử hoặc tinh thể ổn định hơn so với từng nguyên tử riêng lẻ.
Giới thiệu về liên kết hóa học cũng chính là quá trình tìm hiểu động lực đằng sau sự tương tác giữa các nguyên tử. Không chỉ nhằm đạt trạng thái bền, quá trình này còn tạo tiền đề cho sự phong phú của các hợp chất – từ đơn giản như nước cho đến phức tạp như protein hay vật liệu nano. Chính những cơ chế liên kết đa dạng ấy đã mang lại sự phong phú và linh hoạt cho thế giới vật chất mà chúng ta quan sát được ngày nay.
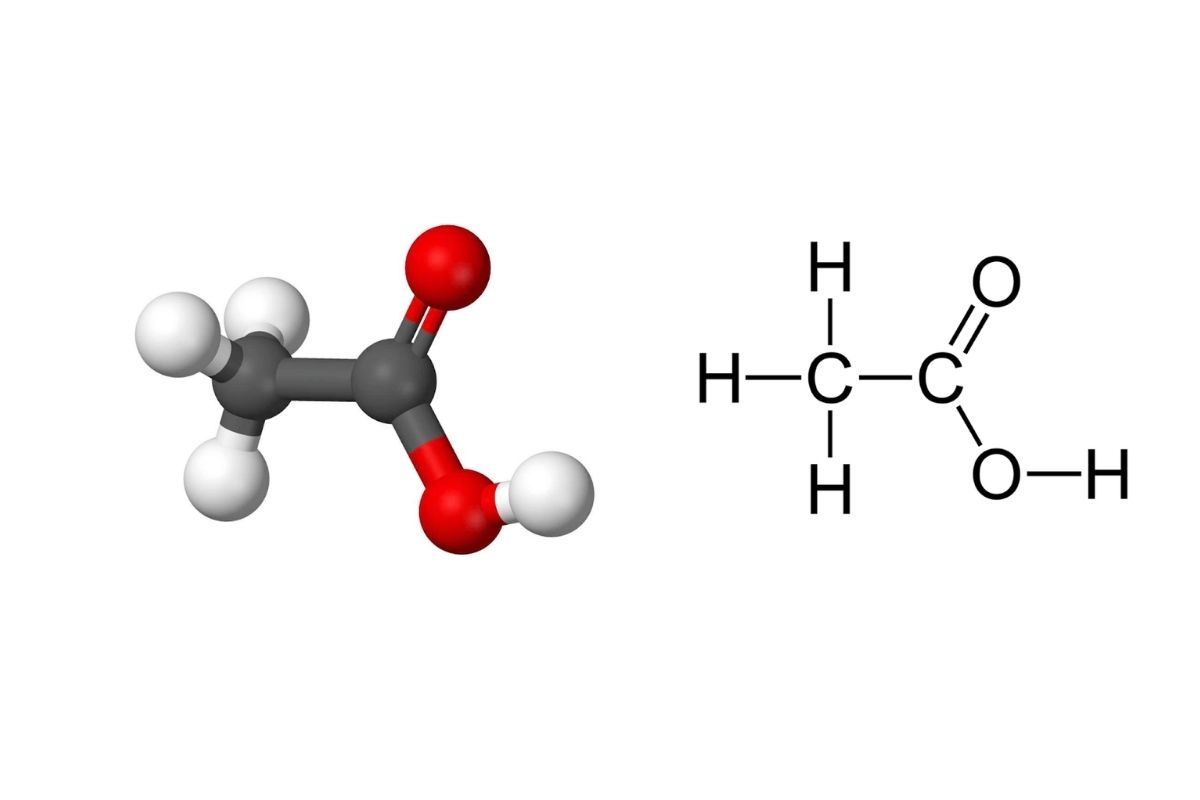
Hướng dẫn phân tích liên kết hóa học từ công thức cấu tạo
Phân tích mối liên kết giữa các nguyên tử trong một phân tử từ công thức cấu tạo.
Để phân tích mối liên kết giữa các nguyên tử trong một phân tử từ công thức cấu tạo, trước hết cần xác định số electron hóa trị và cách các nguyên tử chia sẻ hoặc chuyển giao chúng. Từ công thức Lewis, ta có thể nhận biết số cặp electron dùng chung và kiểm tra xem các nguyên tử đã đạt cấu hình bền vững theo quy tắc octet hoặc duet chưa.
Hiệu độ âm điện giữa các nguyên tử là yếu tố then chốt: nếu chênh lệch lớn, xu hướng hình thành liên kết kiểu ion; nếu nhỏ hơn, các liên kết có thể mang tính phân cực hoặc không phân cực tùy mức độ chia sẻ electron. Ngoài ra, những nguyên tử như hydro liên kết với oxy, nitơ hoặc flo còn có khả năng tạo ra các tương tác yếu như liên kết hydro.
Ví dụ, phân tử nước có liên kết cộng hóa trị phân cực và dễ hình thành cầu nối hydro, trong khi NaCl lại có cấu trúc ion do sự chuyển giao electron hoàn toàn giữa natri và clo. Phân tích như vậy giúp hiểu rõ cách các nguyên tử gắn kết và từ đó suy ra tính chất của chất.
So sánh liên kết hóa học trong hợp chất hữu cơ và vô cơ
Liên kết hóa học trong hợp chất hữu cơ và hợp chất vô cơ có nhiều điểm khác biệt rõ rệt về thành phần nguyên tố và bản chất liên kết:
| Tiêu chí | Hợp chất vô cơ | Hợp chất hữu cơ |
| Thành phần nguyên tố | Có thể có carbon hoặc không | Nhất thiết phải có cacbon, thường có H, O, N… |
| Các loại liên kết trong hóa học | Liên kết ion, liên kết cộng hóa trị phân cực/không phân cực | Chủ yếu là liên kết cộng hóa trị |
| Tính chất vật lý | Nhiệt độ nóng chảy, sôi cao (ion); tan tốt trong nước | Nhiệt độ nóng chảy, sôi thấp, dễ bay hơi, ít tan trong nước |
| Ví dụ | NaCl, CaCO₃, H₂SO₄ | CH₄, C₂H₆, C₆H₆, C₂H₅OH |
Khi đã nắm vững bản chất của liên kết hóa học, chúng ta không chỉ nhìn thấy vật chất dưới lăng kính chính xác hơn, mà còn hiểu được vì sao thế giới vận hành theo cách riêng của nó. Kiến thức này chính là bước đệm quan trọng để nuôi dưỡng tư duy khoa học, đồng thời mở ra những hướng đi mới trong nghiên cứu, sáng tạo và ứng dụng của hóa học hiện đại.


