Đằng sau mọi chất liệu quen thuộc trong cuộc sống – từ không khí ta hít thở đến vật liệu xây dựng kiên cố – đều ẩn chứa một thế giới vi mô đầy kỳ thú. Chính ở cấp độ ấy, phân tử đóng vai trò trung tâm, quyết định đặc điểm và hành vi của vật chất. Khi nắm vững cấu tạo và cách các liên kết hoạt động, chúng ta không chỉ mở rộng hiểu biết khoa học mà còn tạo nền tảng cho những ứng dụng đột phá trong công nghệ và công nghiệp hiện đại.
Phân tử là gì?
Trong thế giới vi mô, có những hạt nhỏ bé được hình thành từ nhiều nguyên tử kết nối chặt chẽ với nhau bằng các liên kết hóa học. Những hạt này chính là đơn vị cơ bản làm nên cấu trúc và tính chất của các chất trong tự nhiên. Dù xuất hiện phổ biến trong hóa học, khái niệm phân tử cũng giữ vai trò quan trọng trong vật lý, sinh học và nhiều lĩnh vực khoa học khác. Chúng có thể được tạo thành từ các nguyên tử giống nhau, như trong khí oxy hay nitơ, hoặc từ các nguyên tử khác loại, chẳng hạn như nước hay khí cacbonic. Điểm đặc biệt là chúng thường không mang điện tích tổng thể, do điện tích dương từ hạt nhân và điện tích âm từ electron luôn ở trạng thái cân bằng.

Đây là đơn vị cơ bản làm nên cấu trúc và tính chất của các chất trong tự nhiên.
Theo thời gian, khái niệm này cũng được mở rộng. Trong vật lý hiện đại, ngay cả những ion phức tạp mang nhiều nguyên tử, hay nguyên tử đơn lẻ như các khí trơ, cũng có thể được xem là phân tử trong một số bối cảnh nhất định. Và khi nói đến việc định lượng trong hóa học, người ta thường đặt câu hỏi số phân tử là gì, nhằm xác định rõ có bao nhiêu hạt như vậy hiện diện trong một lượng chất cụ thể, từ đó phục vụ cho các phép tính chính xác hơn trong nghiên cứu và ứng dụng thực tế.
Cấu tạo phân tử và mối liên hệ với tính chất của chất
Cách các nguyên tử liên kết và sắp xếp với nhau có ảnh hưởng sâu sắc đến tính chất của chất đó. Từ dạng liên kết – có thể là cộng hóa trị, ion hay kim loại – cho đến hình dạng không gian của cấu trúc, tất cả đều góp phần quyết định chất có dễ tan trong dung môi, có dẫn điện hay dẫn nhiệt tốt, và có bền vững về mặt hóa học hay không. Chẳng hạn, nước là một ví dụ điển hình: tuy chỉ gồm ba nguyên tử, nhưng cấu trúc góc của nó tạo điều kiện hình thành các liên kết hydrogen mạnh mẽ, khiến cho nước có điểm sôi cao vượt trội so với nhiều chất có khối lượng tương đương.
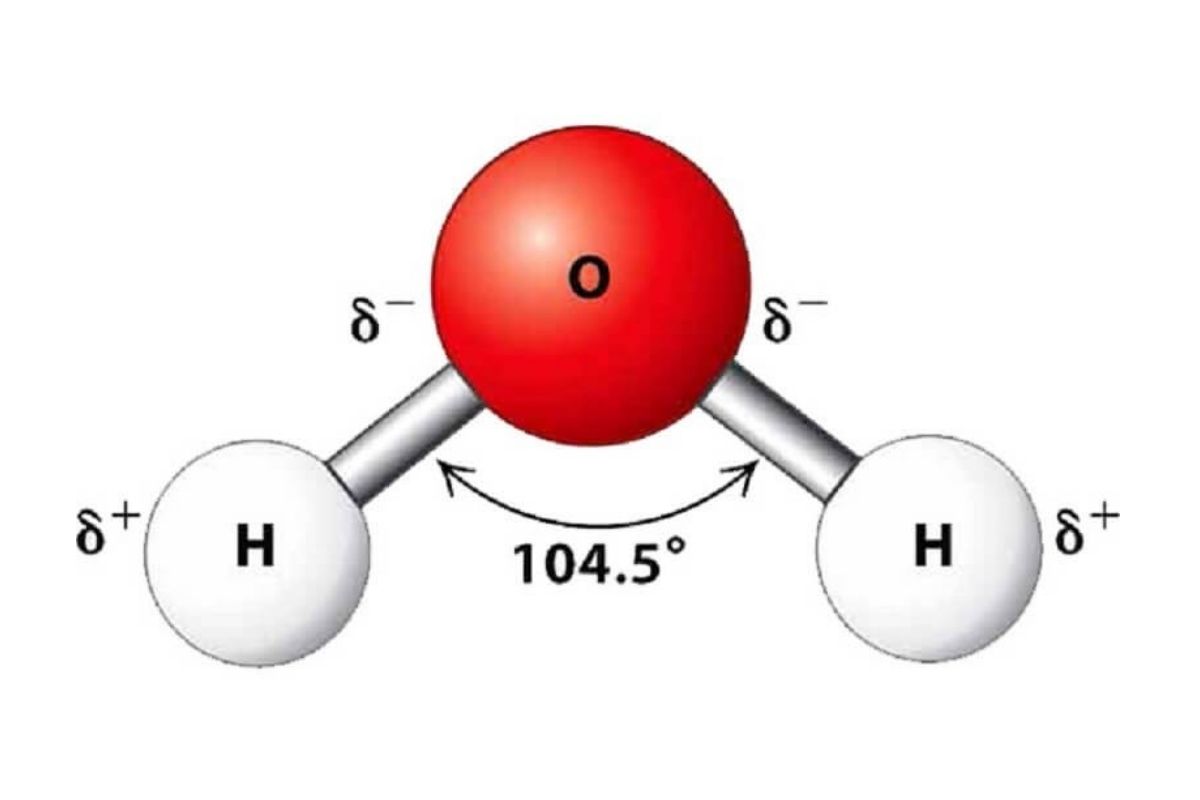
Cách các nguyên tử liên kết và sắp xếp với nhau có ảnh hưởng sâu sắc đến tính chất của chất đó.
Bên cạnh đó, lực tương tác phân tử – tức các lực hút và đẩy giữa các hạt vi mô – cũng góp phần định hình trạng thái vật chất (rắn, lỏng hay khí) và các tính chất vật lý đặc trưng. Khi các hạt tiến lại gần nhau, mức độ ổn định và cấu trúc tổng thể của chất phụ thuộc phần lớn vào sự cân bằng giữa những lực này. Chính vì vậy, việc hiểu rõ cấu trúc ở cấp độ nguyên tử không chỉ giúp giải thích tính chất cụ thể của từng chất mà còn mở ra khả năng dự đoán hành vi của chúng trong các điều kiện khác nhau.
Sự khác biệt giữa nguyên tử và phân tử
Cả 2 loại hạt vi mô này đều dùng để cấu tạo nên vật chất, nhưng có những điểm khác biệt rõ rệt về cấu tạo và vai trò hóa học.
| Tiêu chí | Nguyên tử | Phân tử |
| Khái niệm | Hạt vô cùng nhỏ, trung hòa điện, gồm hạt nhân (proton, nơtron) và electron | Hạt đại diện cho chất, gồm nhiều nguyên tử liên kết với nhau thể hiện tính chất hóa học |
| Ví dụ | Nguyên tử Oxi, nguyên tử Cacbon | O₂, H₂O, CO₂ |
| Hình dạng | Hình cầu | Nhiều hình dạng khác nhau |
| Tính chất | Không thể phân đôi | Có thể tách rời các nguyên tử thành phần |
| Sự tồn tại | Có thể tồn tại hoặc không ở trạng thái tự do | Tồn tại ở trạng thái tự do |
| Khả năng phản ứng | Phản ứng cao (tùy nguyên tố) | Thường ít phản ứng hơn, tham gia vào phản ứng hóa học với vai trò là một đơn vị |
| Liên kết | Liên kết hạt nhân (giữa proton và nơtron) Liên kết hóa học (cộng hóa trị, ion, kim loại) | Liên kết hóa học (cộng hóa trị, ion, kim loại) |
Liên kết hóa học trong phân tử
Ở cấp độ vi mô, các nguyên tử thường liên kết với nhau thông qua những lực tương tác đặc biệt gọi là liên kết hóa học. Đây là yếu tố then chốt tạo nên cấu trúc ổn định cho các chất, từ chất khí đơn giản đến tinh thể rắn.
Các nguyên tử thường liên kết với nhau thông qua những lực tương tác đặc biệt gọi là liên kết hóa học.
Tùy vào cách các nguyên tử tương tác, liên kết có thể mang tính trao đổi hoặc chia sẻ electron, như trong muối ăn hay trong nước. Trong kim loại, các electron chuyển động tự do giúp chất dẫn điện và dẫn nhiệt tốt, còn liên kết hydro – tuy yếu – lại rất quan trọng trong việc duy trì cấu trúc của nước và các chất sinh học.
Chính kiểu liên kết giữa các nguyên tử quyết định hình dạng, độ bền và khả năng phản ứng của mỗi chất, giúp lý giải vì sao cùng một tập hợp nguyên tố nhưng lại tạo nên vô số vật chất khác nhau.
Vì sao hiểu rõ về phân tử lại quan trọng trong công nghiệp?
Việc hiểu rõ cấu trúc và đặc điểm của vật chất ở cấp độ vi mô là chìa khóa để thúc đẩy đổi mới trong công nghiệp hiện đại. Trong thời đại 2025, khi công nghệ gắn liền với AI, IoT và sản xuất xanh, kiến thức này ngày càng trở nên quan trọng.
Chẳng hạn, thiết kế vật liệu siêu nhẹ, chịu nhiệt hay kháng ăn mòn đều bắt đầu từ việc nắm được cách các nguyên tử liên kết và tương tác. Trong y sinh, phân tích cấu trúc hóa học giúp tạo ra thuốc hiệu quả hơn và vật liệu tương thích sinh học. Ngay cả dây chuyền sản xuất thông minh cũng dựa vào dữ liệu vi mô để tối ưu năng lượng, giảm lãng phí.
Khi điện toán lượng tử phát triển, việc mô phỏng cấu trúc một phân tử phức tạp trở nên dễ dàng hơn, rút ngắn thời gian nghiên cứu đáng kể. Điều đó cho thấy hiểu biết ở cấp độ hạt vi mô không chỉ mang tính lý thuyết, mà còn là nền tảng cho công nghiệp bền vững và đổi mới sáng tạo.
Cách viết công thức phân tử chính xác cho hợp chất hóa học
Trong hóa học, xác định đúng thành phần và số lượng nguyên tử trong một chất là bước đầu quan trọng để hiểu rõ tính chất và ứng dụng của nó. Công thức phân tử là gì thường là câu hỏi đầu tiên cần giải đáp, bởi biểu thức này cho biết rõ từng nguyên tố tham gia và cách chúng kết hợp với nhau trong một đơn vị chất.
Để viết công thức chính xác, người ta dựa vào phần trăm khối lượng các nguyên tố, tính số mol tương ứng rồi rút gọn tỉ lệ. Khi biết khối lượng mol (xác định bằng phương pháp hiện đại như khối phổ), ta có thể suy ra công thức đầy đủ. Chẳng hạn, một hợp chất gồm 40% C, 6,67% H và 53,33% O, có khối lượng mol là 60, sẽ có công thức là C₂H₄O₂.
Biểu thức này cho biết rõ từng nguyên tố tham gia và cách chúng kết hợp với nhau trong một đơn vị chất.
Với các chất hữu cơ, cần lưu ý thêm đến đồng phân và hình dạng trong không gian vì chúng ảnh hưởng lớn đến tính chất. Ngoài ra, để phục vụ nghiên cứu và sản xuất, người ta cũng dùng đến số Avogadro – số hạt có trong 1 mol – nhằm tính toán chính xác ở quy mô lớn.
Như vậy, trong kỷ nguyên khoa học – công nghệ phát triển mạnh mẽ, phân tử không chỉ tồn tại trong phòng thí nghiệm hay sách vở, mà còn đóng vai trò trung tâm trong hành trình phát triển công nghệ và cải thiện chất lượng cuộc sống một cách bền vững.


