Độ âm điện hay được hiểu là khả năng hút electron của nguyên tử đóng vai trò then chốt trong hóa học, ảnh hưởng đến cách các nguyên tố liên kết và phản ứng với nhau. Hiểu rõ về đặc tính này giúp ta giải mã nhiều hiện tượng hóa học phức tạp, từ cấu trúc phân tử đến tính chất vật liệu. Bài viết sẽ cùng bạn khám phá sâu hơn về khái niệm này và ứng dụng quan trọng của nó trong thực tế.
Độ âm điện là gì?
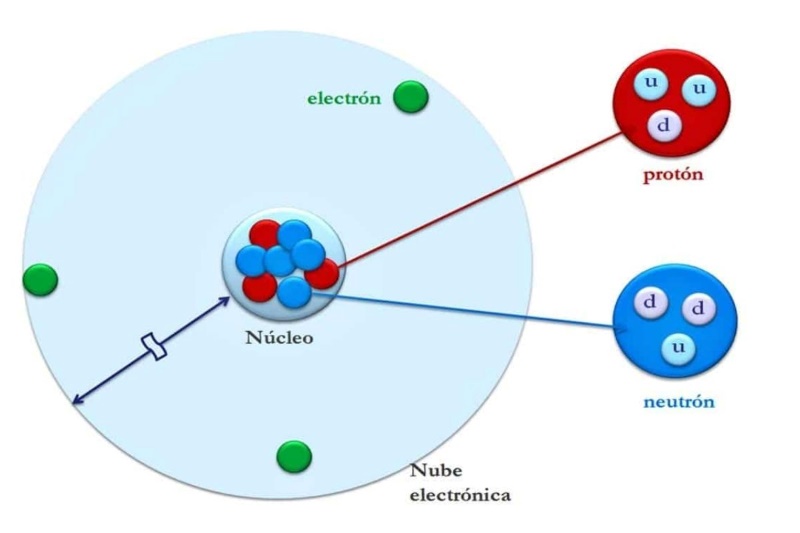
Khả năng hút electron của một nguyên tử là yếu tố then chốt để hiểu cách các nguyên tố tương tác với nhau
Khái niệm về giá trị này nhằm mô tả khả năng hút electron của một nguyên tử khi tham gia liên kết hóa học là một trong những yếu tố then chốt để hiểu cách các nguyên tố tương tác với nhau trong các phân tử. Một nguyên tử càng dễ hút electron về phía mình thì càng thể hiện rõ xu hướng chiếm ưu thế trong liên kết, điều này giúp lý giải vì sao một số nguyên tố mang tính phi kim mạnh trong khi những nguyên tố khác lại thể hiện rõ tính kim loại.
Yếu tố này không giữ nguyên giữa các nguyên tố mà biến đổi theo vị trí của chúng trong bảng tuần hoàn, phản ánh sự khác biệt về cấu trúc nguyên tử và mức độ bền vững của electron lớp ngoài cùng. Vì vậy, ký hiệu độ âm điện trong bảng tuần hoàn không chỉ đơn thuần là một con số mà còn ẩn chứa những thông tin sâu sắc về tính chất hóa học của từng nguyên tố.
Bản chất độ âm điện: Vì sao nguyên tử có xu hướng hút electron?
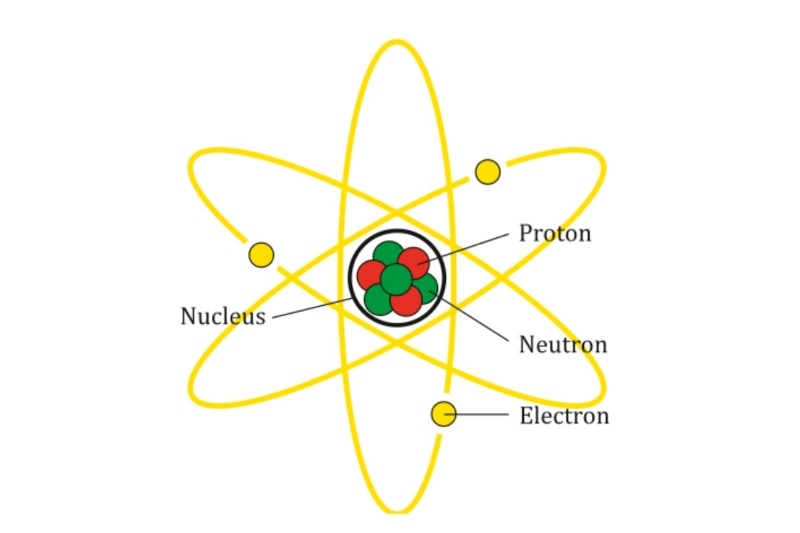
Giá trị này là đặc trưng cho khả năng một nguyên tử kéo electron về phía mình trong một liên kết
Nguyên tử có xu hướng hút electron trong liên kết hóa học vì sự hiện diện của electron – mang điện tích âm – có thể tạo ra sự lệch phân bố mật độ điện tích giữa các nguyên tử. Khi một nguyên tử thu hút electron mạnh hơn đối tác của nó, liên kết giữa hai nguyên tử trở nên phân cực, khiến nguyên tử đó mang phần điện tích âm nhiều hơn. Hiện tượng này bắt nguồn từ lực hút giữa hạt nhân mang điện tích dương và các electron – hạt nhân càng lớn, lực hút càng mạnh, từ đó làm tăng xu hướng chiếm lấy electron liên kết.
Chính vì thế, độ âm điện đặc trưng cho khả năng một nguyên tử kéo electron về phía mình trong một liên kết. Mức độ này khác nhau giữa các nguyên tố, và sự chênh lệch đó đóng vai trò quyết định kiểu liên kết sẽ hình thành – từ liên kết cộng hóa trị không cực đến liên kết ion. Trong bảng tuần hoàn, nguyên tố có độ âm điện lớn nhất là Flo, điều này phản ánh rõ xu hướng cực mạnh của nó trong việc chiếm giữ electron khi tham gia liên kết. Như vậy, có thể hiểu rằng độ âm điện của một nguyên tử đặc trưng cho cách thức và mức độ mà nguyên tử đó ảnh hưởng đến sự phân bố electron trong các hợp chất.
Thang độ âm điện Pauling và những điều cần biết
Flo được chọn làm chuẩn với giá trị 4,0 vì có xu hướng hút electron mạnh nhất
Thang đo phổ biến nhất để thể hiện khả năng hút electron của nguyên tử là thang Pauling, do Linus Pauling thiết lập. Trên thang này, Flo được chọn làm chuẩn với giá trị 4,0 vì có xu hướng hút electron mạnh nhất.
Giá trị trên thang Pauling mang tính tương đối, dựa vào mức độ hút electron so với flo. Trong bảng tuần hoàn, khả năng này thường tăng từ trái sang phải trong một chu kỳ và giảm dần từ trên xuống dưới trong một nhóm.
Để so sánh và dự đoán tính chất liên kết, bảng độ âm điện của các nguyên tố là công cụ quan trọng. Thông qua độ âm điện các nguyên tố, ta có thể đánh giá được mức độ phân cực và loại liên kết hình thành giữa các nguyên tử.
| Nguyên tố | Thang giá trị Pauling |
| F (Flo) | 3.98 |
| Cl (Clo) | 3.16 |
| O (Oxy) | 3.44 |
| N (Nitơ) | 3.04 |
| C (Cacbon) | 2.55 |
| H (Hiđro) | 2.20 |
| Na (Natri) | 0.93 |
| K (Kali) | 0.82 |
Ứng dụng độ âm điện trong dự đoán phản ứng hóa học
Khả năng hút electron của nguyên tử đóng vai trò quan trọng trong việc dự đoán loại liên kết và đặc điểm của phân tử. Khi so sánh giá trị giữa hai nguyên tử liên kết, hiệu số cho thấy mức độ phân cực của liên kết – hiệu càng lớn thì sự phân cực càng rõ, và nếu vượt qua một ngưỡng nhất định, liên kết có thể chuyển sang mang tính ion.
Chẳng hạn, với phân tử NaCl, sự chênh lệch lớn giữa giá trị của clo (3,16) và natri (0,93) – cụ thể là 2,23 – cho thấy liên kết giữa chúng mang tính ion rõ rệt.
Thông tin này không chỉ hữu ích trong việc xác định kiểu liên kết, mà còn giúp dự đoán các đặc điểm hóa học khác như độ phân cực phân tử, tính axit–bazơ, xu hướng tạo liên kết hay khả năng tham gia phản ứng oxi hóa–khử. Chính vì thế, việc nắm được mối liên hệ giữa hiệu giá trị này và loại liên kết là một trong những ứng dụng thực tiễn rõ ràng nhất trong dự đoán phản ứng hóa học.
So sánh độ âm điện giữa kim loại và phi kim
| Loại nguyên tố | Độ âm điện trung bình | Tính chất điển hình |
| Kim loại | Thấp (0.7 – 1.5) | Dễ nhường electron, tính kim loại mạnh |
| Phi kim | Cao (2.0 – 4.0) | Thu hút electron mạnh, tính phi kim mạnh |
Phi kim có giá trị này cao hơn nhiều so với kim loại, do đó phi kim hút electron mạnh hơn trong liên kết hóa học. Ví dụ, gí trị này của Flo (phi kim) là 3,98 trong khi natri (kim loại) chỉ có 0,93. Sự khác biệt này giải thích tại sao các phi kim thường tạo liên kết cộng hóa trị hoặc ion với kim loại.
Cách tính độ âm điện
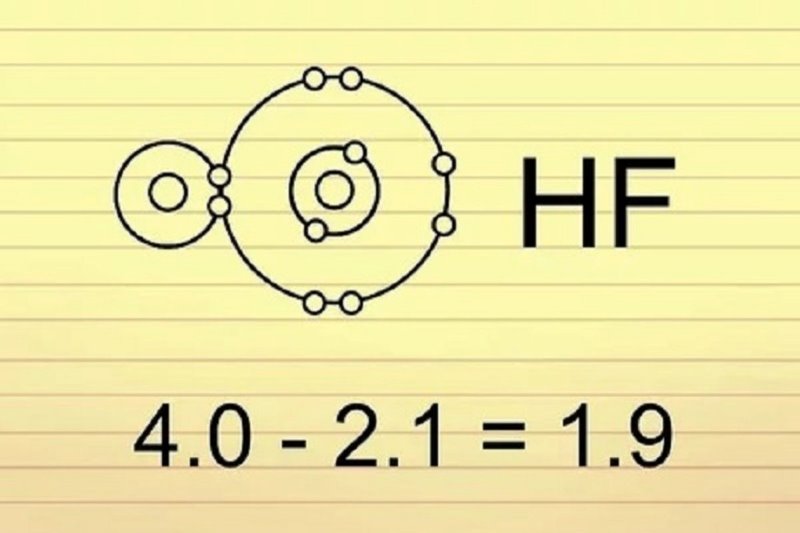
Xác định khả năng hút electron giữa hai nguyên tử trong một phân tử bằng cách tính so sánh sự chênh lệch giá trị giữa chúng.
Việc xác định khả năng hút electron giữa hai nguyên tử trong một phân tử thường bắt đầu bằng cách so sánh sự chênh lệch giá trị giữa chúng. Hiệu này được tính bằng giá trị tuyệt đối của hiệu giữa hai chỉ số tương ứng, từ đó giúp dự đoán mức độ phân cực cũng như loại liên kết có thể hình thành. Đây là nền tảng của cách tính giá trị này trong hóa học phổ thông.
Công thức tính là:
Δχ = ∣χA−χB∣
Trong đó:χA , χB là độ âm điện của nguyên tử A và B.
Với công thức này sẽ giúp chúng ta dự đoán loại liên kết và tính chất phân cực của liên kết.
Hiểu về khả năng hút electron của nguyên tử giúp chúng ta dự đoán chính xác các liên kết và phản ứng hóa học. Việc áp dụng kiến thức về độ âm điện mở ra nhiều cơ hội phát triển trong nghiên cứu và ứng dụng hóa học hiện đại.


