Oxit axit là một trong những hợp chất hóa học vô cơ đóng vai trò then chốt trong nhiều lĩnh vực từ công nghiệp đến môi trường. Hiểu rõ về chúng giúp chúng ta khai thác hiệu quả và kiểm soát tác động của chúng trong đời sống hiện đại.
Khái niệm oxit axit
Oxit axit là gì? Đây là những hợp chất oxit của phi kim hoặc kim loại có số oxi hóa cao, có khả năng tác dụng với nước tạo thành axit hoặc với bazơ tạo thành muối và nước. Chúng còn được gọi là anhidrit axit, bởi vì chúng là dạng oxit tương ứng với các axit.

Hiểu về các loại oxit axit quanh ta.
Ví dụ về oxit axit phổ biến bao gồm: CO₂ (cacbon dioxit), SO₂ (sunfur dioxit), SO₃ (sunfur trioxit), P₂O₅ (photpho pentaoxit), N₂O₅ (đi-nitơ pentaoxit), Cl₂O₇ (clo heptaoxit), CrO₃ (crom trioxit), và Mn₂O₇ (mangan heptaoxit).
Đặc điểm lý hóa của oxit axit
Chúng là những chất thường tồn tại ở dạng khí hoặc rắn, không màu và nhiều khi có mùi hăng khó chịu, như SO₂ chẳng hạn. Điểm nổi bật nhất trong tính chất hóa học của chúng là khả năng phản ứng với nước để tạo ra axit. Ví dụ, P₂O₅ gặp nước sẽ tạo thành axit photphoric.

Chúng có thể tồn tại ở dạng khí hoặc rắn.
Ngoài ra, các oxit axit tác dụng với bazơ, tạo ra muối và nước – phản ứng quen thuộc mà ta thường thấy ở CO₂ với canxi hiđroxit. Đặc biệt, một số trong chúng còn có thể tác dụng với oxit bazơ để tạo thành muối. Những phản ứng này cho thấy chúng có tính axit rõ rệt và dễ dàng tham gia vào nhiều phản ứng hóa học khác nhau.
Quy trình điều chế oxit axit trong phòng thí nghiệm
Trong phòng thí nghiệm, các hợp chất hóa học vô cơ này thường được điều chế bằng cách đốt cháy trực tiếp phi kim hoặc hợp chất có chứa phi kim trong môi trường giàu oxy. Một ví dụ điển hình là khi lưu huỳnh cháy trong không khí sẽ tạo ra SO₂, hay khi photpho được đốt, ta thu được P₂O₅. Những phản ứng này không chỉ đơn giản mà còn giúp dễ dàng thu được sản phẩm có độ tinh khiết cao.
- Ví dụ, đốt cháy lưu huỳnh trong không khí tạo ra SO₂: S + O2 → SO2 + O2
- Đốt cháy photpho tạo P₂O₅: 4P + 5O2 → 2P2O5

Chúng thường được điều chế bằng cách đốt cháy trực tiếp.
Ngoài phương pháp đốt cháy, chúng cũng có thể được điều chế bằng cách oxy hóa các oxit có số oxi hóa thấp hơn, thường thực hiện dưới điều kiện nhiệt độ và xúc tác phù hợp. Việc nghiên cứu quá trình này không chỉ giúp hiểu rõ hơn về cách tạo thành hợp chất, mà còn góp phần làm sáng tỏ khả năng phản ứng linh hoạt của chúng.
Phân loại oxit axit theo nguyên tố cấu thành
Khi xét đến các loại hợp chất vô cơ này, người ta thường phân loại chúng dựa trên nguyên tố cấu thành. Phổ biến nhất là các hợp chất oxit của phi kim như CO₂, SO₂, SO₃, P₂O₅, N₂O₅ hay Cl₂O₇. Những chất này thể hiện rõ tính chất hóa học của oxit axit thông qua phản ứng đặc trưng của chúng khi tác dụng với nước sẽ tạo thành các dung dịch axit tương ứng. Chính vì thế, chúng thường được sử dụng như ví dụ điển hình khi nghiên cứu mối liên hệ giữa cấu trúc phân tử và tính axit trong hóa học.
Bên cạnh nhóm phi kim, vẫn có một số được tạo thành từ kim loại, nhưng là các kim loại ở mức hóa trị cao. Điển hình có thể kể đến mangan heptaoxit (Mn₂O₇) hay crom trioxit (CrO₃). Mặc dù thuộc về nguyên tố kim loại, những oxit này vẫn thể hiện tính chất hóa học tương tự như các loại oxit axit của phi kim, chẳng hạn như khả năng phản ứng với nước hoặc với bazơ để tạo thành axit hoặc muối.
Cách phân loại này không chỉ giúp hiểu rõ nguồn gốc và bản chất của từng loại oxit, mà còn góp phần lý giải sự đa dạng trong hành vi hóa học của chúng trong tự nhiên và phòng thí nghiệm.
Ứng dụng của oxit axit trong đời sống
Oxit axit không chỉ là đối tượng nghiên cứu trong phòng thí nghiệm mà còn hiện diện rộng rãi trong đời sống và sản xuất, đóng vai trò trung gian hoặc nguyên liệu thiết yếu trong nhiều quá trình công nghiệp và sinh hoạt.
Trong nông nghiệp, SO₃ (lưu huỳnh trioxit) là nguyên liệu chính để sản xuất axit sunfuric (H₂SO₄) qua phương pháp tiếp xúc. Axit sunfuric là một trong những hóa chất công nghiệp quan trọng nhất, được mệnh danh là “vua của các hóa chất” vì ảnh hưởng đến nhiều ngành: luyện kim (rửa oxit kim loại), sản xuất phân bón (super photphat, amoni sunfat), chất tẩy rửa, pin axit-chì và tổng hợp hữu cơ.
N₂O₅ (đinitơ pentaoxit) khi tan trong nước tạo ra axit nitric (HNO₃) – một axit mạnh có tính oxy hóa cao. Axit này được sử dụng để sản xuất thuốc nổ (như nitroglycerin, TNT), phân đạm amoni nitrat và trong ngành luyện kim để xử lý bề mặt kim loại.

Chúng có vai trò quan trọng trong sự phát triển nông nghiệp và công nghiệp.
Ngoài ra, N₂O₅ được ứng dụng trong công nghiệp hóa chất với vai trò chất oxy hóa và nguyên liệu tổng hợp các hợp chất nitrat – dùng trong thuốc nổ, dược phẩm và thuốc nhuộm.
Trong nông nghiệp, P₂O₅ (điphotpho pentoxit) phản ứng với nước tạo thành axit photphoric (H₃PO₄) – thành phần chủ đạo trong sản xuất phân bón phốt phát như DAP, MAP. Những loại phân này cung cấp phốt pho, nguyên tố dinh dưỡng không thể thiếu cho sự phát triển của rễ, hoa và quả cây trồng.
Ngoài ra, P₂O₅ còn được sử dụng như một chất hút ẩm mạnh trong công nghiệp thực phẩm và dược phẩm nhờ khả năng hấp thu nước nhanh chóng.
Trong đời sống và môi trường: CO₂ phổ biến với nhiều ứng dụng thực tiễn: tạo ga và bảo quản thực phẩm trong ngành chế biến, điều chỉnh pH trong xử lý nước, và tăng cường quang hợp trong nhà kính để nâng cao năng suất cây trồng.
Trong nghiên cứu và công nghệ cao, Cl₂O₇ tạo ra axit perchloric – axit siêu mạnh dùng trong phản ứng đặc biệt và sản xuất nhiên liệu tên lửa. Chúng cũng góp mặt trong nghiên cứu vật liệu tiên tiến như chất siêu dẫn, pin nhiên liệu và bán dẫn.
Các biện pháp giảm thiểu tác động của oxit axit
Oxit axit, đặc biệt là SO₂ và NOx, là nguyên nhân chính gây ra mưa axit do tính chất hóa học của mình làm cho chúng dễ dàng phản ứng với nước trong khí quyển để tạo axit. Để giảm thiểu tác động tiêu cực này, nhiều giải pháp đã được áp dụng.
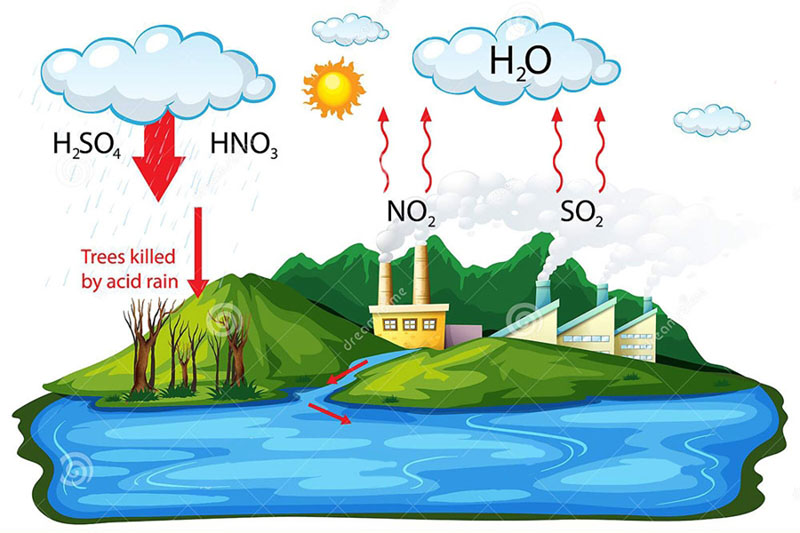
Một trong những biện pháp hiệu quả là kiểm soát khí thải công nghiệp bằng cách sử dụng công nghệ lọc và hấp thụ để giảm lượng oxit axit thải ra. Bên cạnh đó, việc chuyển sang nhiên liệu sạch, ít lưu huỳnh hoặc năng lượng tái tạo cũng giúp hạn chế đáng kể phát thải.
Ngoài ra, trồng cây xanh là cách tự nhiên giúp hấp thụ CO₂, đồng thời cải thiện chất lượng không khí. Việc nâng cao nhận thức cộng đồng cũng rất quan trọng, nhằm giúp mọi người hiểu rõ tác hại và chủ động hơn trong việc bảo vệ môi trường khỏi ảnh hưởng của oxit axit tác dụng với nước và không khí.
Oxit axit không chỉ là thành phần quan trọng trong hóa học mà còn ảnh hưởng sâu sắc đến môi trường và cuộc sống. Việc nắm vững tính chất, ứng dụng và cách kiểm soát chúng sẽ giúp ta phát triển bền vững hơn. Hãy cùng chung tay bảo vệ hành tinh bằng cách sử dụng và xử lý những hợp chất hóa học vô cơ này một cách thông minh và có trách nhiệm.


